INTRODUZIONE
La degenerazione maculare legata all’età (DMLE), come suggerisce il nome stesso, è una patologia che presenta come fattore di rischio principale l’età avanzata, principalmente dopo i 50 anni, sia direttamente che indirettamente se si considera tale fattore come l’accumulo nel tempo dell’effetto di agenti ossidanti interni ed esterni, come il fumo, la dieta, l’inquinamento, lo stile di vita, le comorbidità, la variabilità genetica. L’importanza di questa patologia è soprattutto data dall’impatto sociale che comporta perché il deficit visivo, seppur raramente arrivi comportare una cecità totale, riguarda la porzione centrale del campo visivo come conseguenza della destrutturazione dell’area maculare e foveale deputata alla visione distinta, dove vi è la più alta concentrazione fotorecettoriale di tutta la retina.
SINTOMI
La sintomatologia, nelle fasi iniziali del tutto o quasi impercettibile, si caratterizza nelle fasi più avanzate da una visione distorta delle linee e delle forme degli oggetti (metamorfopsie) fino ad arrivare ad una totale macchia nera centrale (scotoma centrale) nelle forme più gravi, è spesso bilaterale ma asimmetrica.
EPIDEMIOLOGIA
La DMLE, chiamata nel linguaggio anglosassone “AMD” (age-related macular degeneration), è una condizione comune e una delle principali cause di perdita della vista negli anziani. Si prevede che il numero di persone affette aumenterà da 196 milioni nel 2020 a 288 milioni entro il 2040 e che l’Asia avrà la maggior incidenza [1] .Esistono principalmente due forme conclamate di manifestazioni, la cosiddetta forma essudativa, la cui caratteristica sta nel presentare una essudazione a livello intra e/o sottoretinico, proveniente da neovasi coroideali patologici, mentre la seconda tipologia di DMLE è caratterizzata dalla atrofia dei tessuti retinici, per cui viene chiamata forma atrofica, responsabile del 90% dei casi [2]. Talvolta le due forme possono coesistere.
DIAGNOSI
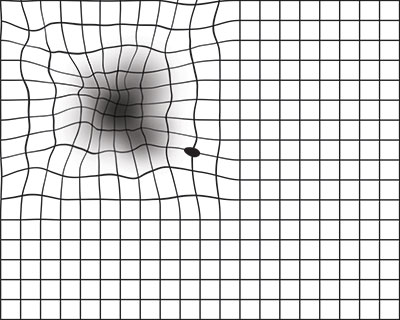
Il percorso valutativo inizia da una accurata anamnesi e prosegue con l’utilizzo di uno specifico dispositivo visivo chiamato “griglia di Amsler” (fig.1) che consiste in una raffigurazione di linee nere su sfondo bianco (o nella variante con linee bianche su uno sfondo nero) con un punto al centro che il paziente, a distanza ravvicinata, deve osservare e riferire eventuali distorsioni di questa griglia (fig.2).

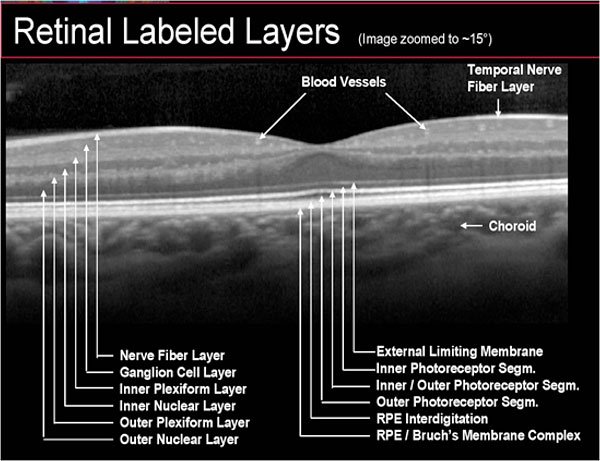
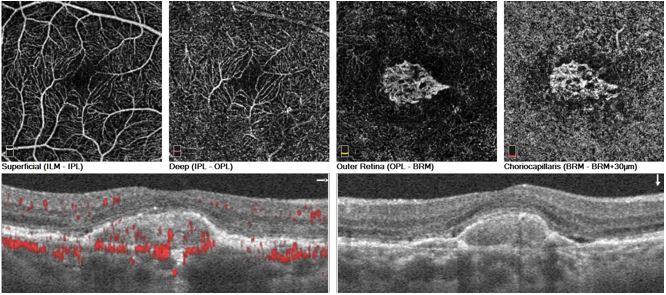
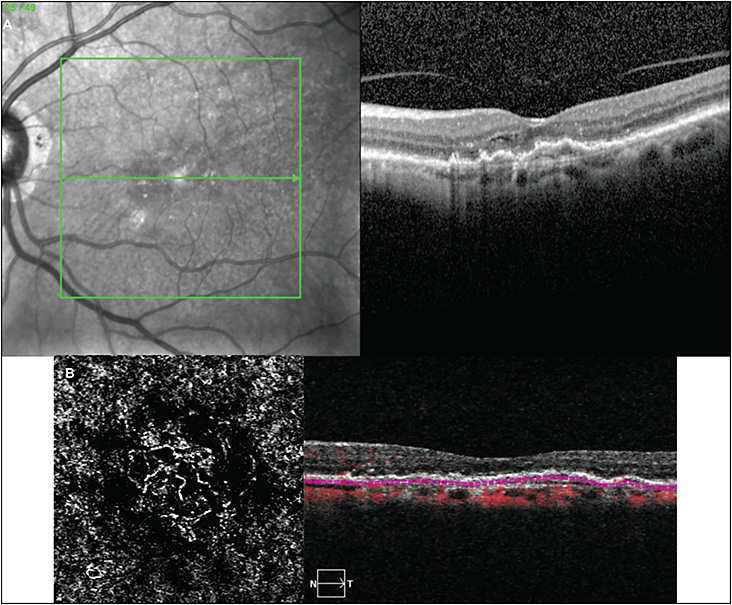
Con l’utilizzo di un oftalmoscopio è possibile, durante l’analisi del fondo oculare, rilevare i segni macroscopici caratteristici, e, passando ad analisi di secondo livello, è essenziale la raccolta di immagini microscopiche prodotte dalla tomografia a coerenza ottica (Optical Coherence Tomography, OCT) (fig. 3) affiancata soprattutto da software in grado di eseguire una valutazione angiografica (angio-OCT) (fig. 4), ovvero mappare i plessi retinici e quindi evidenziare l’eventuale presenza di neovasi anomali. L’angio-OCT è un esame non invasivo che non richiede l’utilizzo di mezzi di contrasto, a differenza della fluorangiografia (FAG).
FORMA ESSUDATIVA (WET-TYPE)
Patogenesi
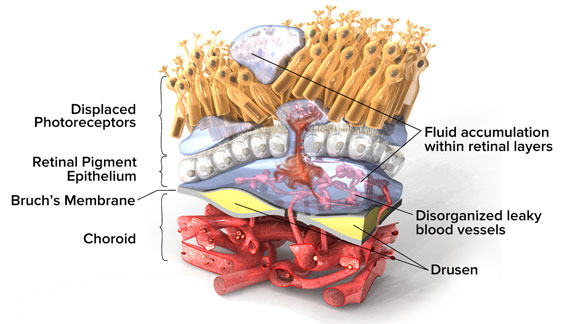
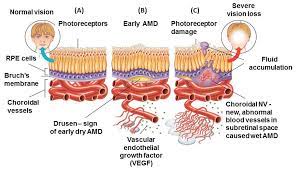
La patologia inizia con una fase pre-essudativa in cui al fondo oculare si evidenziano drusen, ovvero depositi sottoretinici di lipidi e proteine, a cui si associa una disfunzione dell’epitelio pigmentato retinico ed atrofia geografica. Queste alterazioni possono predisporre i tessuti ischemici interessati alla sintesi di VEGF (vascular endothelium growth factor) e conseguente sviluppo di neovascolarizzazioni coroideale ed essudazione sotto e intraretinica. Questi processi sono alla base della forma conclamata della malattia, per i quali prende anche il nome di “coroidal neovascularization (CNV)”.
Segni
Dalla essudazione prodotta dai neovasi e diffusa agli strati retinici attraverso i deficit di integrità della membrana di Bruch, si possono rilevare una serie di alterazioni morfologiche quali il sollevamento retico con distacco del neuroepitelio dall’EPR sottostante, edema intraretinico con conseguente alterazione del profilo fisiologico maculare. (Fig. 4; Fig. 7).
Classificazione
Può essere di tipo 1, se a partenza da vasi esterni all’epitelio pigmentato retinico (EPR), di tipo 2 se interni all’ EPR, o di tipo 3 se l’essudazione proviene da vasi intraretinici, in questo caso viene chiamata anche RAP (retinal angiomatous proliferation). Una forma con caratteristiche peculiari è la “Vasculopatia Polipoidale Coroideale”, che si manifesta spesso in regioni extra maculari, seppur possa avere indirettamente delle conseguenze sulle strutture maculari stesse.
Trattamento
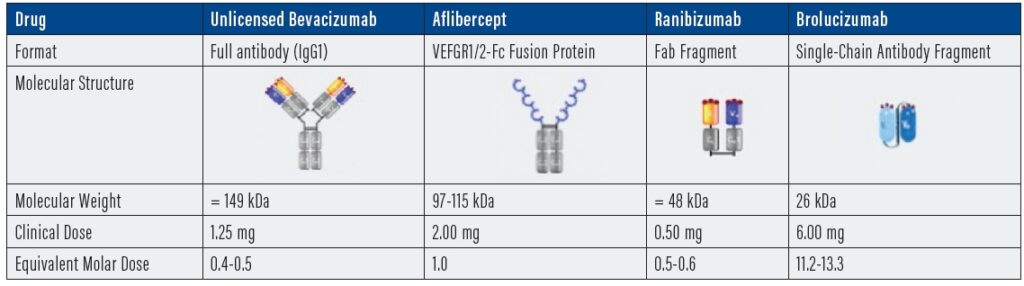
Consta nell’utilizzo di farmaci anti-VEGF somministrati con iniezioni intravitreali (Fig.8) e/o trattamenti laser (terapia fotodinamica) secondo diversi protocolli che prevedono fasi di trattamento multidose alternati a fasi di monitoraggio della efficacia ed eventuali ritrattamenti.
FORMA ATROFICA
La forma atrofia ha una prognosi, per lo meno a breve termine, migliore se confrontata con DMLE essudativa. Il paziente con DMLE atrofica avrà un deterioramento dell’acuità visiva graduale e costante nel tempo [4]. È frequente che siano rilevate altre disfunzioni visive come una diminuzione della sensibilità al contrasto.
Segni
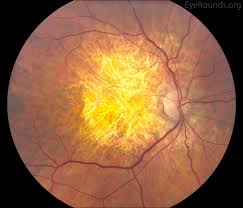
Al di là della presenza, in comune con gli stadi preci della forma essudativa, di drusen e di rimaneggiamento pigmentario per via delle alterazione dell’epitelio pigmentato retinico, la caratteristica che contraddistingue questa forma è l’atrofia di tutti gli strati retinici in diverse regioni, sia maculare che perimaculare (cosiddetta atrofia geaografica). Questo comporta quindi la perdita irreversibile della visione centrale. All’esame obiettivo, i vasi coroideali appariranno più evidenti nelle aree interessate, conseguentemente all’atrofia del tessuto retinico sovrastante. (Fig.9). Il processo fisiopatologico può portare alla produzione di fattori angiogenici fino a far coesistere, successiva alla formazione di una membrana neovascolare coroideale, la forma atrofica a quella essudativa.
Trattamento
Non vi sono ad oggi terapie efficaci. La prevenzione dai fattori di rischio e l’assimilazione di antiossidanti per contrastare la quota ossidativa che contribuisce alla patogenesi della malattia sono le uniche armi al momento adottabili, al di là delle terapie sperimentali, che pure ci sono ma con le quali non sono stati raggiunti risultati ancora validi per contrastare gli effetti irreversibili di questa patologia. Riguardo le sostanze più utili da integrare nella diete per combattere lo stress ossidativo retinico la ricerca scientifica da più di 20 anni ha raggiunto risultati significativi, tanto da poter dichiarare con gli studi “ AREDS” le componenti e i dosaggi consigliati per diminuire il rischio di progressione della DMLE atrofica [5].
RIFERIMENTI
1. Keenan TDL, Cukras CA, Chew EY. Age-Related Macular Degeneration: Epidemiology and Clinical Aspects. Adv Exp Med Biol. 2021;1256:1-31. doi: 10.1007/978-3-030-66014-7_1. PMID: 33847996.
2. Fernandes AR, Zielińska A, Sanchez-Lopez E, Dos Santos T, Garcia ML, Silva AM, Karczewski J, Souto EB. Exudative versus Nonexudative Age-Related Macular Degeneration: Physiopathology and Treatment Options. Int J Mol Sci. 2022 Feb 26;23(5):2592. doi: 10.3390/ijms23052592. PMID: 35269743; PMCID: PMC8910030.
3. Neil M. Bressler, Susan B. Bressler, Stuart L. Fine, Age-related macular degeneration, Survey of Ophthalmology, Volume 32, Issue 6,1988, Pages 375-413,ISSN 0039-6257.
4. Michalska-Małecka K., Kabiesz A., Nowak M., Śpiewak D. Age related macular degeneration—Challenge for future: Pathogenesis and new perspectives for the treatment. Eur. Geriatr. Med. 2015;6:69–75. doi: 10.1016/j.eurger.2014.09.007.
5. Age-Related Eye Disease Study Research Group. The Age-Related Eye Disease Study (AREDS): design implications. AREDS report no. 1. Control Clin Trials. 1999;20(6):573–600. doi:10.1016/s0197-2456(99)00031-8.