Quali sono i pericoli dell’uso delle lenti a contatto? Perché sentiamo tanto dolore quando un corpo estraneo entra nell’occhio? Ogni occhio rosso è una congiuntivite? Perché una cornea danneggiata perde la sua trasparenza e diventa bianca?
In questo articolo troverete le risposte a tutte queste domande e ulteriori informazioni sui seguenti punti:
- Anatomia e fisiologia della cornea
- Eziologia ed epidemiologia della cheratite
- Principali cause di cheratite infettiva
- Principali cause di cheratite non infettiva
Anatomia e fisiologia della cornea
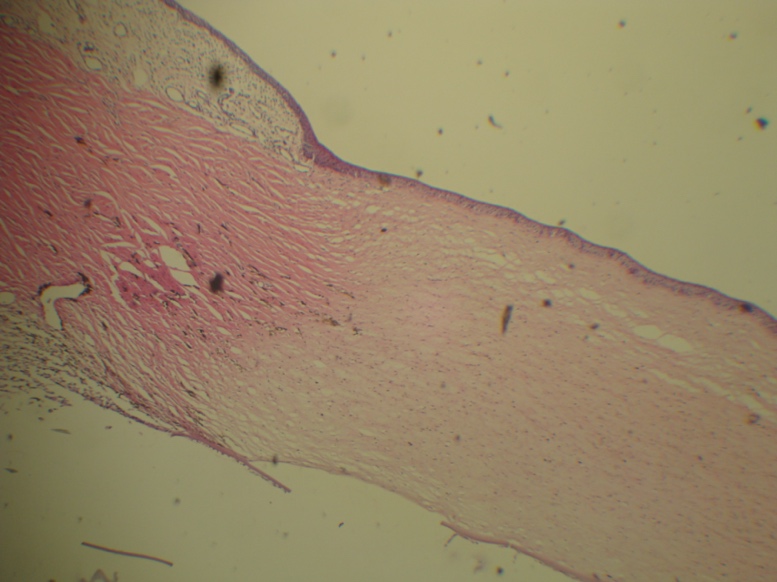
La cornea è il tessuto più anteriore dell’occhio e ha due importanti funzioni: protezione del contenuto intraoculare e rifrazione della luce. È una membrana trasparente e avascolare composta da 5 strati (epitelio, membrana di Bowman, stroma, membrana di Descemet ed endotelio); ha uno spessore di 500 micron nella porzione più centrale e fino a 1 mm in periferia e le sue dimensioni raggiungono i 12 mm di diametro in orizzontale e gli 11 mm in verticale. La cornea continua con la sclera nella sua parte posteriore, costituendo lo strato oculare più esterno e offrendo protezione all’occhio. Entrambe sono costituite dallo stesso tipo di fibre collagene, principalmente dal collagene di tipo I, sebbene contengano anche fibre collagene di tipo IV e V.
Quindi, se sono costituite dalle stesse cellule, perché la sclera è bianca, mentre la cornea è trasparente? Diversi fattori giocano un ruolo importante:
- La trasparenza della cornea dipende dal grado di regolarità spaziale nella disposizione delle fibre di collagene, cioè nella cornea il collagene forma fogli che scorrono in modo ortogonale. A differenza della sclera, in cui il collagene è disposto in modo arbitrario e disorganizzato.
- Come abbiamo già detto, il tessuto corneale non contiene vasi sanguigni, è avascolare. La cornea si nutre per diffusione attraverso il film lacrimale, l’umor acqueo e le neurotrofine rilasciate dalle fibre nervose.
- Le terminazioni nervose non sono ricoperte da mielina. I fasci nervosi del nervo trigemino perdono il perineuro e le guaine mieliniche in corrispondenza del limbus sclerocorneale, attraverso il quale penetrano nello stroma corneale. Il tessuto corneale contiene la più alta concentrazione di terminazioni nervose del corpo umano. Per questo motivo gli occhi sono così sensibili all’ingresso di corpi estranei. Curiosità: la cornea ha un numero di recettori del dolore 20 volte superiore a quello della polpa dentale e 300-600 volte superiore a quello della pelle.
- In condizioni normali, la cornea si trova in uno stato di relativa disidratazione. La percentuale di acqua (78%) è mantenuta dall’endotelio corneale attraverso le sue funzioni di barriera e di pompa endoteliale.
Tutti questi fattori contribuiscono al corretto funzionamento della cornea. Quando uno di essi viene meno, c’è una predisposizione a danneggiare questo tessuto.
Eziologia ed epidemiologia della cheratite
Il termine “cheratite” deriva dall’unione dei suoi componenti lessicali: keratos, corno o cornea, e il suffisso -itis, che significa infiammazione. Pertanto, la cheratite comprende tutte quelle patologie che provocano un danno alla cornea.
I sintomi principali della cheratite sono l’arrossamento dell’occhio, il dolore, la diminuzione della vista, il blefarospasmo e la secrezione congiuntivale. L’esame biomicroscopico rivela occhi iperemici, con opacità biancastre che indicano infiltrati, reazione della camera anteriore e persino ipopione.
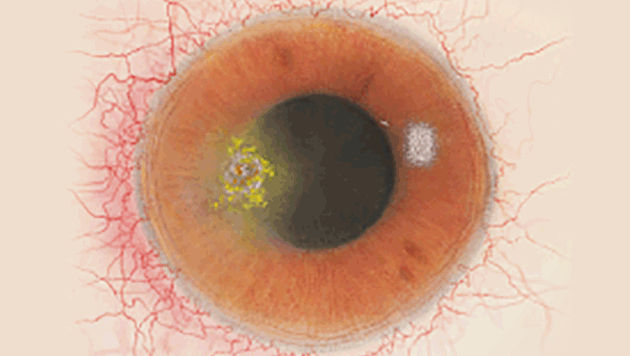
Quando l’iperemia congiuntivale è associata a iniezione ciliare, oltre a suggerire la presenza di un coinvolgimento corneale, può aiutarci a localizzare la lesione. Ad esempio, se troviamo un’area di iperemia più pronunciata nella zona limbare (iniezione ciliare), cercheremo la lesione corneale vicino ad essa. Come si può vedere nel disegno sottostante, in cui l’infiltrato corneale è localizzato a livello temporale paracentrale. Questo può essere utile per le lesioni più piccole che possono passare inosservate.
Esistono alcuni fattori predisponenti allo sviluppo della cheratite come: alterazioni epiteliali nella malattia dell’occhio secco, ostruzione dei dotti lacrimali, uso di lenti a contatto, traumi oculari, alterazioni palpebrali o carenze nutrizionali, tra gli altri.
CHERATITE INFETTIVA:
- Batterica: Stafilococco, Streptococco, Pseudomonas, Neisseria.
- Virale: Herpes simplex, Herpes zoster, Adenovirus.
- Fungine: Fusarium, Aspergillus, Candida
- Parassitario: Acanthamoeba
CHERATITE NON INFETTIVA: Artrite reumatoide, Lupus eritematoso sistemico, Cheratite a scudo, Cheratite marginale, Poliarterite nodosa, Sindrome di Sjrögen, Ulcera di Mooren.
Principali cause di cheratite infettiva
Batterica
L’87% delle cheratiti batteriche è causato da agenti patogeni appartenenti ai seguenti gruppi: Staphylococcus (batterio più frequente), Streptococcus, Pseudomonas ed Enterobacteriaceae (Citrobacter, Klebsiella, Enterobacter, Serratia, Proteus). In un occhio sano, l’epitelio corneale fornisce una barriera di difesa che impedisce ai microrganismi di penetrare nella cornea. L’interruzione dei meccanismi protettivi compromette la barriera funzionale e rende qualsiasi batterio un patogeno opportunistico. Tuttavia, alcuni microrganismi più virulenti sono in grado di penetrare attraverso l’epitelio sano, come Neisseria gonorrhoeae, Corynebacterium diphtheriae e Haemophilus.
I fattori che predispongono all’infezione corneale batterica possono essere esogeni o endogeni. Tra i fattori esogeni vi sono l’uso di corticosteroidi topici o sistemici, l’uso di lenti a contatto (in particolare il tempo di utilizzo, che non dovrebbe superare le 5-6 ore al giorno, o il loro uso inappropriato, ad esempio in piscina o al lago) o danni termici o chimici che possono influenzare la superficie corneale e i meccanismi di difesa sopra menzionati. Curiosità: l’uso continuo di lenti a contatto di giorno e di notte aumenta di 10-15 volte il rischio di cheratite batterica. I fattori endogeni comprendono le condizioni che alterano il meccanismo di difesa della superficie oculare che prevede una superficie corneale liscia, un film lacrimale con enzimi antibatterici, l’ammiccamento involontario e la migrazione dei leucociti dalla congiuntiva quando necessario.
- Disfunzione palpebrale: trichiasi o disallineamento delle ciglia verso la cornea, malposizione palpebrale come entropion o ectropion, blefarite o laroftalmo.
- Disfunzione lacrimale: iposecrezione di lacrime dovuta a infiltrazione della ghiandola lacrimale o a malattie autoimmuni, dacriocistite o canalicolite.
- Disfunzione congiuntivale: tracoma, congiuntivite virale (per questo alcuni autori raccomandano l’uso di antibiotici topici preventivi nel trattamento della congiuntivite virale) o pemfigoide oculare.
- Disfunzioni corneali: ipoestesia corneale dovuta ad anestesia trigeminale, erosioni corneali ricorrenti, cheratopatia bollosa o ulcere erpetiche.
- Malattie sistemiche: alcolismo, coma, disfunzione lacrimale nel diabete mellito, malattie autoimmuni, carenza di vitamina A o malnutrizione.
La patogenesi della cheratite infettiva batterica si basa sullo squilibrio tra i meccanismi di difesa e la virulenza dei microrganismi. I batteri possono causare alterazioni corneali secernendo esotossine: proteasi, coagulasi, lipasi e collagenasi che degradano il tessuto corneale e ne permettono la penetrazione (sia GRAM + che GRAM -); ed endotossine presenti nella parete dei GRAM – rilasciate dopo la loro lisi.
Il quadro clinico è caratterizzato da dolore (sintomo cardinale), fotofobia, lacrimazione, blefarospasmo, diminuzione della vista e presenza di secrezione mucopurulenta (quest’ultimo sintomo è più frequente nella congiuntivite che nella cheratite, quindi non sarà il sintomo principale).
Nell’esame biomicroscopico possiamo trovare:
- Ulcere epiteliali o stromali. Perdita di tessuto epiteliale o stromale corneale. La colorazione con fluoresceina e la luce blu cobalto possono essere utili per la diagnosi. I difetti epiteliali sono evidenziati da una colorazione gialla. È importante misurare le dimensioni dell’ulcera e annotarle nella storia clinica per valutarne l’evoluzione.
- Infiltrato corneale. Un infiltrato corneale è una lesione con perdita di trasparenza e decolorazione biancastra, spesso localizzata nello stroma. Quando questi infiltrati sono più densi, vengono chiamati ascessi.
- Iperemia congiuntivale bulbare e iniezione ciliare o pericolare, che può essere a 360º o settoriale in prossimità della lesione corneale.
- Essudato mucopurulento.
- Reazione della camera anteriore. Quando le cellule si depositano per gravità e creano un livello, si parla di ipopione.
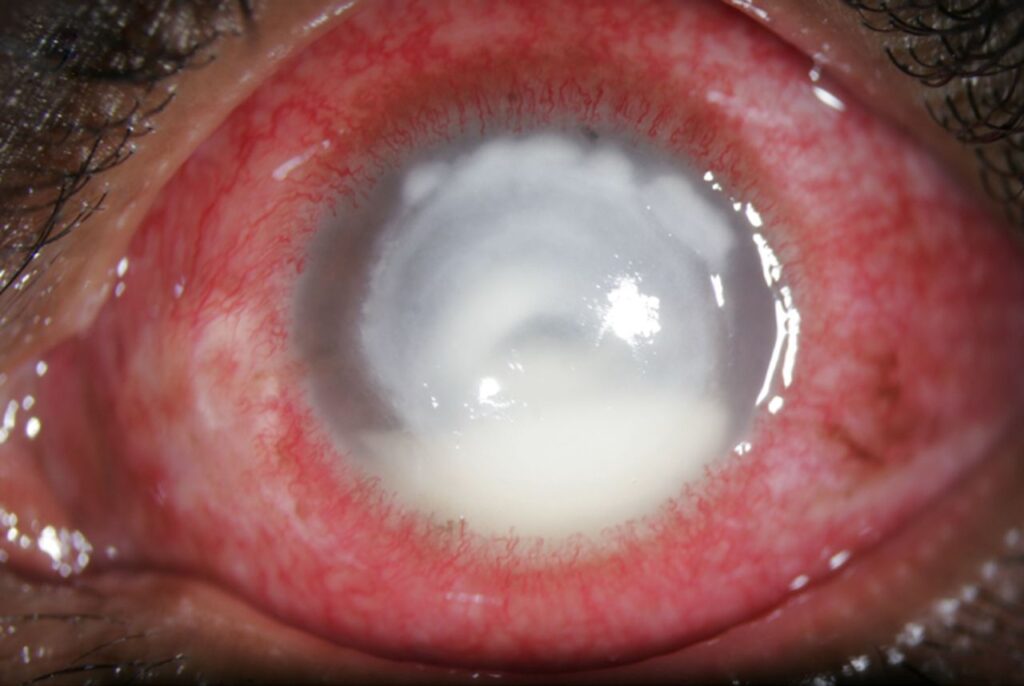
La microbiologia è essenziale per la diagnosi di questa patologia. È importante sottolineare che non bisogna ritardare il trattamento antibiotico empirico prima di prelevare i campioni per la coltura. Per analizzare gli agenti patogeni coinvolti nell’infezione, si esegue un raschiamento corneale per prelevare un campione (utilizzando uno strumento di disepitelizzazione o un ago da insulina per prelevare materiale corneale dall’infiltrato, cercando di muoversi verso l’interno dall’esterno dei bordi della lesione). Oltre alla coltura, possiamo utilizzare il campione per eseguire colorazioni utili alla diagnosi, come la colorazione GRAM.
L’aspetto dell’ulcera non è solitamente utile per la diagnosi. Alcune caratteristiche del quadro clinico possono fornire indicazioni: uno scarico giallo-verdastro in un infiltrato in rapida evoluzione con un esteso coinvolgimento corneale suggerirà Pseudomonas, mentre la presenza di blefarite suggerirà Staphylococcus. I batteri GRAM – tendono a produrre cheratite con essudato aderente più rapidamente progressivo, edema maggiore e infiltrati più ampi con bordi poco definiti. I batteri GRAM+, invece, tendono a produrre infiltrati più localizzati, ovali e grigiastri, con modesto edema corneale perilesionale.
| Cocchi GRAM + | Cocchi GRAM – | Bacilli GRAM – |
| Stafilococco Streptococo | Neisseria | Pseudomonas Escherichia Shigella Klebsiella Proteus Enterobacter Serratia Moraxella |
Virale
La cheratite virale è spesso accompagnata da un coinvolgimento congiuntivale ed è nota come cheratocongiuntivite. Ha diverse eziologie, tra cui l’adenovirus (ADV), l’herpes simplex virus (HSV), l’herpes zoster virus (HZV) e il citomegalovirus (CMV).
L’adenovirus è l’agente patogeno responsabile della febbre faringocongiuntivale (adenovirus tipo 3 e 7) e della cheratocongiuntivite epidemica (adenovirus tipo 1 – 4, 5, 8, 19 e 37). La febbre faringocongiuntivale raramente colpisce la cornea, presentandosi di solito come congiuntivite follicolare con occhi infiammati senza abbondante secrezione purulenta. Nella cheratocongiuntivite epidemica, invece, il coinvolgimento corneale è maggiore. Nelle fasi croniche della malattia, dopo una fase acuta di infiammazione congiuntivale, compaiono infiltrati subepiteliali, opacità corneali comunemente chiamate noduli. Hanno un decorso autolimitante, ma possono essere trattati con corticosteroidi in modo decrescente. Inoltre, possono formarsi pseudomembrane sul tarso che, con l’ammiccamento e il grattamento, possono portare alla formazione di erosioni epiteliali corneali.
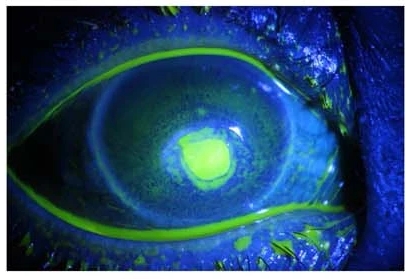
L’Herpes simplex virus di tipo 1 è la causa più comune di cecità infettiva nei Paesi industrializzati. È un virus a DNA che causa due quadri clinici oculari: l’infezione primaria e l’infezione oculare ricorrente. La prima infezione è solitamente asintomatica, si manifesta nei primi anni di vita e rimane latente nel ganglio trigemino cervicale, nel ganglio simpatico e nella cornea. Le presentazioni oculari sono congiuntivite acuta con linfoadenopatia e malessere o cheratite dendritica con blefarite ulcerosa. Le vescicole, come quelle mostrate nell’immagine, sono patognomoniche di infezione da herpes.
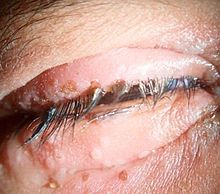
L’infezione ricorrente è solitamente unilaterale ed è causata dalla riattivazione del virus latente. La sede del virus corrisponde alla sede dell’infiammazione corneale:
- Blefarocongiuntivite.
- Cheratite epiteliale: dendritica, geografica e ameboide. L’esame alla lampada a fessura rivela vescicole corneali, ulcere dendritiche, ulcere marginali o ulcere geografiche. Le dendriti sono la forma più caratteristica di presentazione. Si tratta di un’ulcera arboriforme che si colora con la fluoresceina. Il 50-70% guarisce senza trattamento e fino al 25% delle ulcere non trattate può diffondersi allo stroma corneale e viene trattato con antivirali topici come l’aciclovir 3% applicato 5 volte al giorno per 14 giorni.
- Cheratite stromale: cheratite stromale necrotizzante e cheratite stromale immune. La cheratite stromale necrotizzante è associata a una grave infiammazione con un elevato rischio di perforazione corneale. In questi casi il virus è presente in fase di replicazione e induce distruzione cellulare e infiammazione locale. La cheratite stromale immune, invece, si manifesta con opacità stromali con epitelio intatto. In questi casi non c’è replicazione virale, il coinvolgimento è causato esclusivamente dall’infiammazione. Vengono trattate con farmaci antivirali topici e sistemici e l’uso di corticosteroidi è controverso.
- Cheratite neurotrofica. Come abbiamo già spiegato, l’HSV può depositarsi in modo latente nella cornea. Una delle conseguenze è l’anestesia corneale. Si tratta di ulcere corneali con associata infiammazione più lieve e riduzione della lacrimazione.
- Cheratite endoteliale. I segni clinici più caratteristici sono la presenza di precipitati cheratici endoteliali con edema corneale e reazione infiammatoria nella camera anteriore. Sono associati a un aumento della pressione intraoculare, superiore a 20-25 mmHg. A seconda della forma di questi precipitati, si distinguono tre gruppi: disciforme, diffuso o lineare. Il trattamento si basa su corticosteroidi topici e, se necessario, sull’uso di colliri ipotensivi.
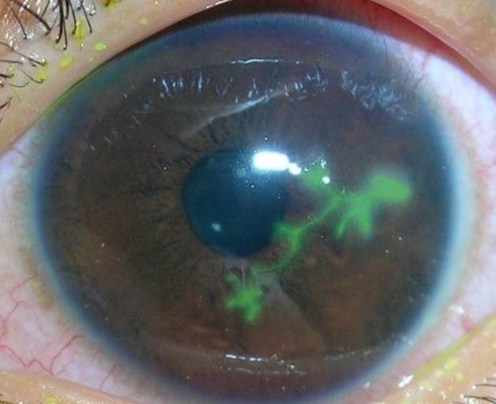

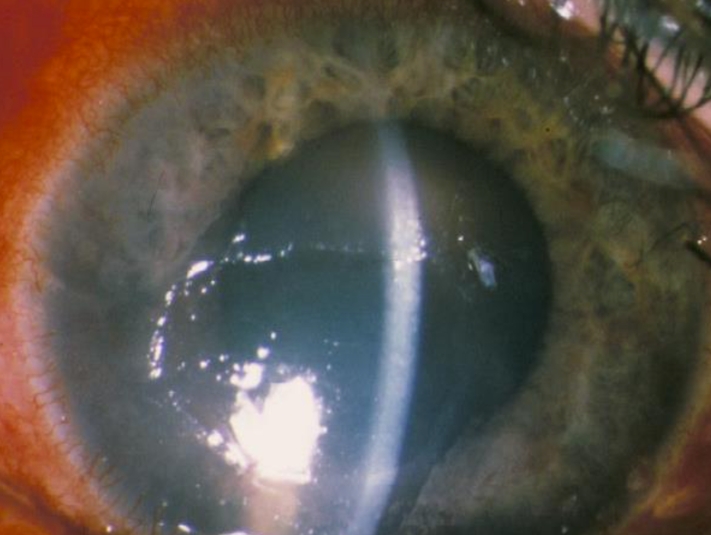
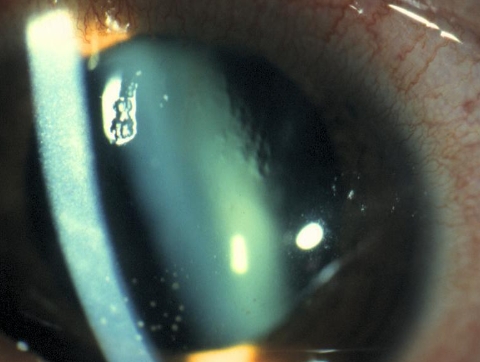
Herpes zoster oftalmico. Questo virus colpisce l’occhio quando interessa la branca V1 del nervo trigemino. Le manifestazioni cliniche sono dolore, lacrimazione, fotofobia, occhio rosso e, caratteristicamente, edema palpebrale marcato. L’esame rivela edema corneale, cheratite epiteliale e/o stromale, uveite, pressione intraoculare elevata e ipostesia corneale. Il trattamento si basa su farmaci antivirali topici, corticosteroidi topici e pomata a base di eritromicina in caso di coinvolgimento congiuntivale associato. Un dato interessante: se troviamo lesioni sulla punta del naso, possiamo osservare un coinvolgimento oculare fino al 75% dei casi. Questo è il segno di Hutchinson.
Parassitaria
Il parassita più comune che causa la cheratite è l’Acanthamoeba. Si tratta di un protozoo ubiquitario nel suolo, nell’aria e nell’acqua. Esiste una forma attiva, il trofozoite (a sinistra), e una forma inattiva, la cisti (a destra).
Possono causare una serie di malattie nell’uomo, come la meningoencefalite amebica granulomatosa grave e spesso fatale o la malattia amebica granulomatosa disseminata. Entrambe le patologie si verificano in pazienti immunocompromessi. Tuttavia, la cheratite da Acanthamoeba si verifica in individui immunocompetenti, il 90% dei quali sono portatori di lenti a contatto con scarsa igiene ed esposti a determinati ambienti contaminati, come l’acqua di laghi e piscine. Curiosità: l’incidenza attuale è stimata in un caso ogni 300.000 portatori di lenti a contatto all’anno, la maggior parte (88%) con lenti a contatto morbide.

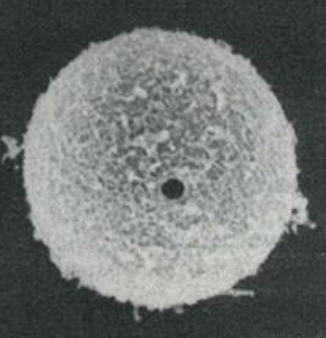
Il restante 10%, i portatori di lenti non a contatto, sono stati esposti ad ambienti contaminati, a traumi o a precedenti interventi chirurgici sulla cornea. Nei pazienti con una storia di traumi, le amebe possono raggiungere lo stroma corneale direttamente attraverso l’esposizione e nei portatori di lenti a contatto questo accesso è facilitato da microtraumi ripetuti, anche se sappiamo che A. castellanii attraversa l’epitelio intatto attraverso la secrezione di proteine citolitiche indotte dal mannosio.
La cheratite amebica è dolorosa e invalidante. I pazienti avvertono forte dolore, lacrimazione, diminuzione della vista e fotofobia. Il quadro clinico varia a seconda dello stadio dell’infezione. Inizialmente, le amebe si trovano a livello epiteliale e progrediscono verso lo stroma corneale.
L’esame del paziente nelle prime fasi della malattia può rivelare irregolarità epiteliali, opacità focali, edema microcistico, infiltrati stromali anteriori e cheratoneurite radiale. I sintomi del paziente possono essere sproporzionati rispetto all’esame biomicroscopico.
Con il progredire dell’infezione, si riscontrano infiltrati anulari, iperemia limbare, placche endoteliali, fusione corneale, edema corneale e reazione della camera anteriore che può formare ipopione.
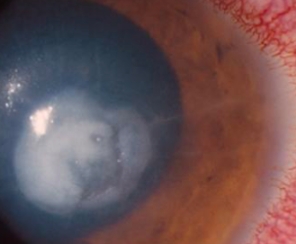
Una buona anamnesi è essenziale per la diagnosi di questa patologia. Nell’anamnesi clinica bisogna indagare sull’uso delle lenti a contatto e sulla loro igiene, sulle variazioni della soluzione di pulizia delle lenti, sull’esposizione ad acqua contaminata o ad altre possibili fonti di infezione e su una storia di traumi.
Ricordiamo che i segni clinici riscontrati possono non corrispondere all’intensa sintomatologia presentata dal paziente.
La microscopia confocale in vivo può essere di grande aiuto in questi pazienti, poiché permette di visualizzare direttamente gli agenti patogeni in tempo reale. L’immagine più caratteristica che si può osservare in questo test sono le cisti a doppia parete (come quelle contrassegnate dalla freccia gialla nell’immagine), che a volte formano dei grappoli, localizzate nell’epitelio nelle fasi iniziali o nello stroma corneale nelle fasi più avanzate.

Per quanto riguarda i test diagnostici di laboratorio, possiamo coltivare un campione corneale mediante coltura su piastra agar ed eseguire colorazioni come GRAM o GIEMSA per fare una diagnosi differenziale con la cheratite batterica. La coltura di questo patogeno è difficile, per cui esistono test alternativi come la biopsia corneale o la PCR di un campione corneale.
Il trattamento della cheratite da Acanthamoeba mira a eradicare i trofozoiti e le cisti e a controllare la risposta infiammatoria. Se l’infezione è precoce e a livello epiteliale, la stessa disepitelizzazione per il prelievo della PCR può essere curativa. I farmaci antiparassitari utilizzati sono biguanidi combinati con diamidine ogni ora per la prima settimana e distanziati in base all’evoluzione della malattia. Si raccomanda di mantenere il trattamento per 1-2 mesi dopo la risoluzione dell’infiammazione.
Micotica
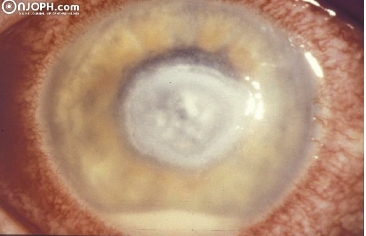
Le cheratiti a eziologia fungina sono meno frequenti di quelle batteriche, essendo più frequenti quelle prodotte da funghi filamentosi (Fusarium o Aspergillus) che da funghi lieviti (Candida). Il principale fattore di rischio è il trauma con materiale vegetale, mentre altri fattori sono l’uso di lenti a contatto, la terapia cronica con corticosteroidi topici, la chirurgia corneale e la cheratopatia cronica. Si presentano come infiltrati a insorgenza subacuta, lesioni suppurative che di solito sono ulcerate e presentano lesioni satelliti e un’infiammazione intensa nella camera anteriore (ipopione) come si vede nell’immagine sottostante.

Queste sono le caratteristiche cliniche più tipiche degli infiltrati fungini:
- Margini diffusi
- Superficie irregolare
- Bordi sfocati
- Pigmentazione brunastra
- Presenza di lesioni satelliti
- Infiltrazione stromale profonda con epitelio adiacente intatto
- Presenza di un anello infiammatorio (anello di Wesselly).
Per la diagnosi microbiologica si può ricorrere alla coltura in terreno di Saboreud o all’esame istologico (che di solito si esegue quando sono stati eseguiti tutti gli altri esami, strisci e colorazioni).
Principali cause di cheratite non infettiva
Questo gruppo comprende diverse eziologie di infiammazione corneale di origine non infettiva, tra cui troviamo: la malattia dell’occhio secco, la cheratite interstiziale, l’interessamento corneale in malattie reumatologiche come l’artrite reumatoide o il lupus eritematoso sistemico, la cheratite marginale stafilococcica, l’ulcera di Mooren o la cheratite superficiale di Thygeson puntata, tra le altre.
Ulcera di Mooren
Si tratta di un’ulcerazione periferica a decorso cronico e di causa sconosciuta. Fino al 50% dei casi è bilaterale. Inizia dal margine corneale ed evolve lentamente in senso circonferenziale verso il resto della periferia, associandosi a dolore.
Cheratite interstiziale
È una cheratite in cui è presente una vascolarizzazione e un’infiltrazione non suppurativa che interessa lo stroma corneale ed è associata a una malattia sistemica (sifilide congenita, sindrome di Cogan, linfogranuloma venereo o parotite, tra le altre).
Malattia di Thygeson
È una cheratite che si presenta con episodi di sensazione di corpo estraneo, fotofobia e lacrimazione. Occasionalmente, quando le lesioni interessano l’asse visivo, possono essere accompagnate da una diminuzione della vista.
Di solito è bilaterale e il suo trattamento si basa su corticosteroidi topici.
