Introduzione
Il termine “glaucoma” si riferisce ad un gruppo di neuropatie ottiche degenerative caratterizzate da una cosiddetta “escavazione” della testa del nervo ottico, chiamata anche papilla ottica, ossia la parte più distale del secondo nervo cranico, visibile con un esame del fundus oculi grazie alla sua conformazione anatomica che lo vede addentrarsi attraverso i tessuti del bulbo (fig. 1, fig.2). Tale escavazione è una manifestazione indiretta della perdita di cellule ganglionari della retina e dei loro assoni, con conseguente perdita della vista corrispondente, evidenziabile durante un esame che valuta il campo visivo.
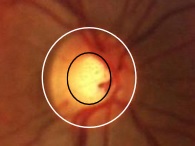
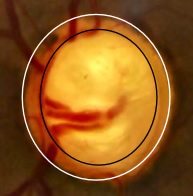
Epidemiologia
Il glaucoma è un importante problema di salute pubblica ed è la causa principale di cecità irreversibile in tutto il mondo (1). Gli individui di origine africana o di etnia ispanica hanno un aumentato rischio di glaucoma primario ad angolo aperto (POAG), mentre le persone di origine asiatica hanno un rischio aumentato di sviluppare glaucoma ad angolo chiuso (PCAG). In individui provenienti da paesi scandinavi la sindrome pseudoesfoliativa rappresenta un’alta percentuale di casi di glaucoma. La prevalenza (numero totale di individui con una malattia in un momento specifico) e l’incidenza (numero di nuovi casi che si sviluppano durante un periodo specifico) di POAG variano ampiamente tra campioni basati sulla popolazione a causa di differenze nella rappresentazione etnica e razziale, un esempio è che la prevalenza è 4-5 volte più alta fra gli individui neri che gli individui bianchi (2).
Fattori di rischio
Le cause del glaucoma sono multifattoriali e comprendono sia fattori ambientali che genetici (il gene della miocillina, MYOC, è stato il primo gene associato al glaucoma, ma ce ne sono decine correlabili ad un aumentato rischio). La pressione intraoculare (IOP) è un fattore di rischio cosiddetto “continuo” per l’impatto crescente nel progredire della patologia man mano che i suoi valori aumentano, ma non è una caratteristica distintiva della malattia. Un elevata IOP può causare stress meccanico sulle strutture dell’occhio, in particolare alla lamina cribrosa, che è il punto più debole della parete posteriore dell’occhio, e dei suoi tessuti adiacenti, il che può risultare nella compressione, deformazione e rimodellamento della lamina cribrosa con possibile interruzione del trasporto assonale. Il valore di 21 mmHg (2 deviazioni standard superiori alla media) è stato tradizionalmente utilizzato sia per separare una pressione “normale” dalle pressioni “anormali” che per definire quali pazienti richiedessero terapia oculare ipotensiva. L’ipertensione oculare (OHT) è definita come la presenza di elevata IOP in assenza di glaucoma, campo visivo alterato o danno del disco ottico. Se da un lato una grande percentuale di pazienti con OHT non sviluppa glaucoma, dall’altro una grande percentuale di pazienti con glaucoma primario ad angolo aperto hanno IOP nell’intervallo convenzionalmente considerato “normale”.
Molti geni e regioni genomiche sono stati stati associati a vari tipi di glaucoma. Nei pazienti con glaucoma, l’IOP basale, indipendentemente dal suo valore numerico, è troppo alto per la funzione e la sopravvivenza delle cellule gangliari retiniche. E’ stato dimostrato che nella maggior parte dei pazienti con glaucoma, diminuire l’IOP arresta o rallenta la perdita di campo visivo , sebbene in alcuni casi il danno al nervo ottico può progredire nonostante l’abbassamento dell’IOP (3).Poiché l’età avanzata è un fattore di rischio importante per il glaucoma e poiché le aspettative di vita sono in aumento nella maggior parte delle popolazioni, la prevalenza del glaucoma è in aumento. E’ stato stimato che entro il 2020 circa 80 milioni persone in tutto il mondo avranno il glaucoma (4).
Un ulteriore fattore predisponente è l’ipotensione arteriosa. Valori troppo bassi infatti possono compromettere la corretta perfusione a livello oculare.
Lo spessore della cornea viene spesso misurata per contestualizzare la misurazione della pressione intraoculare(IOP), poiché se da un lato una cornea più spessa potrebbe far sovrastimare la IOP, dall’altro una cornea più sottile potrebbe invece pericolosamente sottostimarla.
La miopia elevata è un fattore di rischio per il glaucoma primario ad angolo aperto, mentre l’ipermetropia è un fattore di rischio per la chiusura dell’angolo. L’uso prolungato di corticosteroidi topici, inalati o sistemici può causare un aumento dell’IOP, specialmente in soggetti predisposti.
Classificazione
I glaucomi sono classificati per età di esordio [congenito, giovanile (JOAG, definito da una insorgenza prima dei 40 anni), dell’ adulto ], eziologia (primaria vs secondaria), e dopo una valutazione gonioscopica dell’anatomia dell’angolo iridocorneale (aperto vs chiuso).Nel glaucoma ad angolo aperto (OAG) la condizione è ulteriormente classificata come “glaucoma primario ad angolo aperto (POAG)” quando non si riconosce nessuna anomalia specifica alla base del quadro patologico, mentre viene definito come “secondario” qualora un’anomalia giochi un ruolo nella patogenesi del glaucoma. Nella chiusura angolare, l’iride periferica ostruisce parzialmente o completamente la rete trabecolare, l’ostruzione può essere causata da un contatto dovuto ad una apposizione irido-trabeculare o ad una vera e propria adesione tra le due strutture, nota come sinechia anteriore periferica (PAS) ed anche in questo caso si possono distinguere forme primarie e secondaria. In alcuni casi il normale flusso di umore acqueo in una chiusura angolo primario (e in alcune forme di chiusura angolo secondario) dalla camera posteriore a quella anteriore è ostruito a livello della pupilla, così il gradiente di pressione risultante spinge l’iride periferica in avanti restringendo così la camera anteriore, questa condizione è nota come “chiusura d’angolo da blocco pupillare”. In alcune forme di chiusura dell’angolo secondario l’iride periferica viene spinta in avanti anche senza che ci sia un blocco pupillare, restringendo l’angolo iridocorneale, e ciò può derivare da un’anomalia del corpo ciliare, tumori del segmento posteriore, emorragia, o altre cause come l’ingombro di una cataratta matura nel caso del glaucoma facomorfico.
Altre forme di chiusura d’angolo non sorgono per via di una spinta posteriore ma di una trazione a livello angolare, un esempio di queste forme è il glaucoma neovascolare, nel quale, conseguentemente a patologie oculari di tipo ischemico, come può essere una occlusione venosa retinica o una retinopatia diabetica grave, si ha la formazione di neovasi a livello irideo e angolare, creando un ingombro al deflusso dell’umor acqueo e alterazioni strutturali al trabecolato stesso.
Il Glaucoma familiare a pressione normale (NTG) è associato a mutazioni della optineurina (OPTN).
Il Glaucoma può essere anche solo una della manifestazione di sindromi che includano uno spettro di anomalie oculari e sistemiche come nella sindrome di Axenfeld-Rieger, nella Aniridia congenita o nella sindrome pseudoesfoliativa (causa più comune di glaucoma secondario ad angolo aperto).
Segni e sintomi
Anche se le forme più comuni di glaucoma sono di solito asintomatiche fino anche alle fasi tardive, alcune condizioni, come la chiusura angolo acuta, sono generalmente accompagnati da dolore, arrossamento e diminuzione della vista. Pazienti con angoli anatomicamente stretti e intermittenti chiusure d’angolo possono riportare una storia di mal di testa e visione di aloni colorati intorno alle luci, sintomi suggestivi di una elevazione acuta della pressione intraoculare (IOP).
Un aumento delle dimensioni della cornea associata a rotture nella membrana di Descemet (strie di Haab) si trova comunemente nei pazienti con glaucoma infantile che hanno avuto l’esordio di una IOP elevata prima dell’età di 4 anni.
Il cosiddetto Fuso di Krukenberg (Fig. 3) si riscontra nella sindrome di dispersione del pigmento, mentre una deposizione di materiale esfoliante si trova invece nella sindrome di pseudoesfoliazione (Fig. 4).
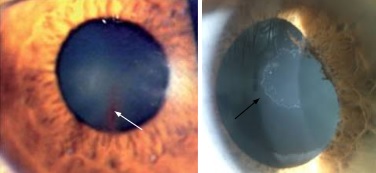
Figura 4: depositi fibrillari nella sindrome pseudoesfoliativa (freccia nera).
Precipitati cheratici si riscontrano nell’uveite, oppure un aspetto “bronzo battuto” nella sindrome endoteliale iridocorneale.
Per stimare la profondità della camera anteriore è utile impiegare il metodo Van Herick che consiste nello stimare la distanza tra i riflessi corneale e irideo di un fascio di luce stretto a fessure passante circa a 60° sulla superficie corneale (Fig. 5).
L’iride a Bombé e l’iride del plateau possono entrambi avere una camera anteriore profonda centralmente e bassa perifericamente. Al contrario, nel glaucoma maligno e altre forme di chiusura angolo con blocco pupillare, un meccanismo di “spinta” posteriore rende la camera anteriore ipoprofonda sia nella porzione periferica che centrale. La camera anteriore è invece molto profonda con una configurazione dell’iride spesso concava nella sindrome da dispersione di pigmento.

Diagnosi
La gonioscopia è necessaria per visualizzare l’anatomia dell’angolo.
La tonometria come quella ad applanazione è lo standard per la misurazione della pressione intraoculare.
Il fondo oculare è essenziale per la visualizzazione della papilla ottica e la misurazione della escavazione, ed analisi di eventuali altri segni di sofferenza nervosa dovuta al glaucoma come la presenza di emorragie a fiamma peripaillari, inginocchiamenti dei vasi sulla rima papillare o atrofia peripapillare. Esami strumentali come l’OCT (tomografia a coerenza ottica) (Fig. 6) e il Campo Visivo computerizzato (Fig. 7) sono utili per analizzare la morfologia degli strati delle cellule ganglionari e dello strato delle fibre nervose col primo e misurare la loro funzionalità residua col secondo.


Terapia
Il razionale terapeutico è quello di riequilibrare il ciclo della produzione-riassorbimento dell’umor acqueo.
Il tasso di produzione di umor acqueo è 2-3 μL/ min mentre sveglio, diminuendo di circa 50% durante il sonno. Poiché il volume del segmento anteriore è di circa 200-300 μL, il volume totale dell’occhio di umore acquoso è riciclato circa ogni 100 minuti.
L’umore acqueo entra nella camera posteriore dai seguenti meccanismi fisiologici che avvengono nell’epitelio ciliare a doppio strato:
• secrezione attiva
• ultrafiltrazione
• semplice diffusione
Varie classi di farmaci possono sopprimere la formazione di umor acqueo o aumentarne il deflusso.
L’inibizione dell’enzima anidrasi carbonica oppure il blocco dei recettori β2-, i recettori adrenergici più diffusi nell’epitelio ciliare, può ridurre la formazione di umor acqueo.
Il deflusso dell’umore acqueo avviene per 2 principali meccanismi:
-attraverso la via trabecolare(o convenzionale) sensibile alla pressione
– attraverso la via uveosclerale(o non convenzionale) insensibile alla pressione, che contribuisce da un 5% fino al 45% del deflusso totale dell’acqua. Questo meccanismo diminuisce con l’età, è ridotto nei pazienti con glaucoma e da agenti miotici, mentre è aumentato da cicloplegia, agenti adrenergici e analoghi della prostaglandina.
La rete trabecolare è classicamente divisa in 3 strati: uveale, corneosclerale e juxtacanaliculare. Lo strato juxtacanaliculare forma la parete interna del canale Schlemm da cui un complesso sistema di canali collettori fa defluire l’umor acqueo nel circolo venoso che drena nelle vene episclerali, successivamente nella parte anteriore vene oftalmiche ciliari e superiori e queste a loro volta nel seno cavernoso, ne consegue che quelle condizioni che possono compromettere una corretta circolazione venosa (es. trombosi del seno cavernosi, malattie della tiroide) aumentano la resistenza al deflusso dell’umor acqueo e il rischio di aumento della IOP.
Se da un lato con l’età il numero cellule trabecolari (circa 200.000-300.000 per occhio) diminuisce e la membrana basale si addensa, aumentando le resistenze al deflusso, dall’altro il tasso di formazione di umore acqueo diminuisce, così come negli stati di infiammazione intraoculare, dopo la somministrazione di alcuni farmaci sistemici e dopo un trauma oculare, seppur quest’ultimo possa anche essere associato a recessione angolare e glaucoma traumatico.
La terapia medica si basa sull’utilizzo soprattutto di ipotonizzanti oculari, topici o sistemici, che agiscono principalmente su due meccanismi:
-produzione di umor acqueo
-riassorbimento dell’umor acqueo attraverso la via trabecolare e la via uveosclerale (che contribuiscono rispettivamente al 75% e al 25% in media).
Le principali classi di farmaci ad uso topico utilizzate sono le seguenti:
-Le Prostaglandine e gli agenti miotici, che aumentano il deflusso dell’umore acqueo
-I β-bloccanti non selettivi e gli inibitori dell’anidrasi carbonica, che diminuiscono a produzione di umore acqueo
-Gli α2 agonisti e gli inibitori delle RHO kinasi, che hanno una parziale efficacia su entrambi i meccanismi.
I vari principi attivi utilizzati possono avere un potere decrementale sulla pressione oculare che varia tra il 15% e poco più del 30%, in base alla classe del farmaco e alla risposta del singolo individuo, inoltre, nella pratica clinica è comune associare più principi attivi per potenziare l’efficacia della terapia medica.
Per quanto riguarda la terapia sistemica, presa in considerazione nei casi più refrattari a terapia topica o per la necessità di una più rapida ed incisiva diminuzione della IOP, vengono usati principalmente:
-inibitori dell’anidrasi carbonica, sia per via orale che endovenosa, come acetazolamide
– agenti osmotici, per via endovenosa, come mannitolo o glicerolo.
Nei casi di camera anteriore particolarmente bassa, di sospetto blocco pupillare o glaucoma ad angolo stretto, una possibile soluzione, temporanea o definitiva, può essere quella di eseguire una “iridotomia”, che avrebbe come effetto quello di riequilibrare i flussi pressori tra le camere posteriore ed anteriore, evitando così il rischio di chiusura d’angolo e spikes pressori.
I trattamenti chirurgici per il glaucoma sono progettati per abbassare la pressione intraoculare (IOP).
Nel caso di procedimenti ciclodistruttivi, si mira a ridurre la produzione di umor acqueo.
Nella trabeculoplastica laser (LTP), l’energia laser viene applicata alla rete trabecolare aumentando il flusso di umor acqueo.
La Trabeculectomia è una procedura incisionale in cui si crea una fistola tra la camera anteriore e lo spazio sottocongiuntivale, bypassando la via di deflusso normale. L’uso intraoperatorio sempre più frequente di antimetaboliti quali mitomicina C e 5- fluorouracile ha migliorato il tasso di successo di questa chirurgia.
Gli impianti tubolari sono progettati per deviare l’umor acqueo dalla camera anteriore allo spazio sottocongiuntivale equatoriale. In generale gli impianti tubolari possono essere suddivisi in tipi valvati e non valvati. Le indicazioni e le considerazioni preoperatorie per gli impianti tubulari sono simili a quelli per trabeculectomia. Questi impianti sono stati storicamente utilizzati in occhi che avevano fallito trabeculectomie precedenti, che avessero stati infiammatori attivi, neovascolarizzazioni o gravi cicatrici congiuntivali.
Dopo l’intervento chirurgico per la cataratta, pazienti con ipertensione oculare o glaucoma possono avere una riduzione dell’IOP, per questo questa chirurgia ha acquisito un posto anche nel ventaglio delle soluzioni chirurgiche del glaucoma, sia da sola che in chirurgie combinate.
Procedure non penetranti per il trattamento del glaucoma sono interventi chirurgici incisionali che non prevedono un ingresso in camera anteriore; il loro obiettivo è quello di abbassare l’IOP evitando alcune delle possibili complicazioni della trabeculectomia quali il rischio infettivo, emorragico o di ipotono postoperatorio. Queste procedure non penetranti includono sclerectomia profonda, Viscocanalostomia, e canaloplastica.
Bibliografia
1. Bourne RR, Taylor HR, Flaxman SR, et al. Number of people blind or visually impaired by glaucoma worldwide and in world regions 1990–2010: a meta- analysis. PLoS One. 2016;11(10):e0162229.
2. Leske MC, Connell AM, Wu SY, et al. Incidence of open- angle glaucoma: the Barbados EyeStudies. The Barbados Eye Studies Group. Arch Ophthalmol. 2001;119(1):89–95.
3. Quigley HA. Glaucoma. Lancet. 2011;377(9774):1367–1377.
4. Tham YC, Li S, Wong TY, Quigley HA, Aung T, Cheng CY. Global prevalence of glaucoma and projections of glaucoma burden through 2040: a systematic review and meta-analysis. Ophthalmology. 2014;121(11):2081–2090.